![]()

可能用到的相对原子质量: H-1 C-12 O-16 C1-35.5 Ca-40
五、选择题(每小题只有一个选项符合题意。每小题2分,共16分)
18、下列四个事例中一定发生了化学变化的是

①玻璃片上出现水珠 ②大理石投入到稀盐酸中 ③自制汽水 ④品红在水中扩散
A.①② B.②③ C.③④ D.①④
19、下列实验操作错误的是
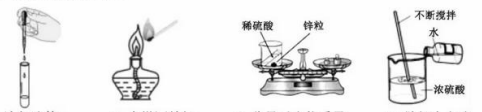
A.滴加液体 B.点燃酒精灯 C.称量反应物质量 D.稀释浓硫酸
20、下列说法:①二氧化硫和臭氧都是空气污染物;②洁净的空气和水都是纯净物;③因为水体有自净能力,所以生活污水可任意排放;④降低可燃物的着火点是灭火的途径之一;⑤烧碱和熟石灰的溶液都显碱性;⑥复合肥中一定要含有氮、磷、钾三种元素;⑦如果将化合物按有机化合物和无机化合物两大类划分,则葡萄糖和尿素应属于有机化合物。其中正确的是
A.①⑤⑦ B.①②④⑥ C.④⑤⑦ D.①②⑤⑥
21、小雨同学依据描述书写的化学符号:①3个锌原子;3ZN;②两个氢分子:2H2;③两个氢氧根离子:2OH-;④原子结构示意图![]() 对应的粒子:Mg2+;⑤氯化亚铁的化学式:FeCl2;⑥-2价的氧元素:O2-。其中正确的有
对应的粒子:Mg2+;⑤氯化亚铁的化学式:FeCl2;⑥-2价的氧元素:O2-。其中正确的有
A.②③⑤ B.①⑤⑥ C.②③④ D.①③⑤
22、一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量/g | 50 | 0.5 | 0 | 0 |
反应后的质量/g | 23 | X | 24 | 3 |
A.x的值等于0.5 B.甲一定是化合物
C.丙和丁的质量变化比为8:1 D.该反应是化合反应
23、金属钨(W)可做白炽灯泡的灯丝。用黑钨矿[主要含有FeWO4(钨酸亚铁)]制得金属钨(W)的工艺流程如下图所示:
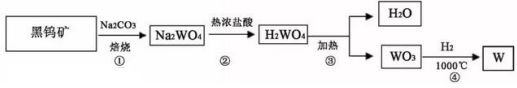
其主要反应原理如下:
①4FeWO4+4Na2CO3+O2![]() 4Na2WO4+2Fe2O3+4CO2
4Na2WO4+2Fe2O3+4CO2
②Na2WO4+2HCl(热浓)=H2WO4+2NaCl
③H2WO4![]() H2O+WO3 ④3H2+WO3
H2O+WO3 ④3H2+WO3 ![]() W+3H2O
W+3H2O
下列说法不正确的是
A.反应③属于分解反应 B.反应①②③④的产物都有氧化物
C.反应①④中有元素的化合价发生改变 D.为加快反应的速率,可将黑钨矿石碾成粉末
24、下列关于物质的组成、结构、性质及变化规律的总结,正确的是
A.C、CO、CO2组成中都含有碳元素,故参与反应时均具有碳的还原性
B.HCl和NaOH反应生成了盐和水,故有盐和水生成的反应都是复分解反应
C.酸溶液都含有H+,故酸都有相似的化学性质
D.浓H2SO4、NaOH都具有吸水性,故它们都能用来干燥二氧化碳气体
25、一定质量的甲烷在不充足的氧气中燃烧,甲烷完全反应,生成物只有CO、CO2和H2O,且总质量为20.8g,其中H2O的质量为10.8g,则CO2的质量为
A.5.6g B.8.8g C.4.4g D.4.8g
六、填空简答题(本题包括3小题,共13分)
26、(4分)化学基础与常识
(1)下图金属应用的实例,主要利用金属的导热性的是_______(填序号);

A电缆 B.电热壶 C.金属丝 D.金属乐器
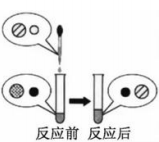
(2)向氢氧化钠溶液中滴加稀盐酸至恰好完全反应,反应前后溶液中存在的离子种类如图所示(其中“○”“![]() ”“●”“
”“●”“ ![]() ”表示不同离子)。则“○”与“
”表示不同离子)。则“○”与“![]() ”反应生成了_________(填物质名称)。
”反应生成了_________(填物质名称)。
(3)氢氟酸(HF)能刻画玻璃,其中有一个化学反应的化学方程式是: CaSiO3+6HF=X+SiF4↑+3H2O,则X的化学式为_______________
(4)氢能是一种极具发展潜力的清洁能。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。
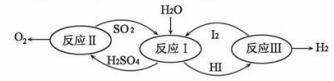
写出反应I中,发生反应的化学方程式:_____________________________。:
27、(5分)化学就在我们身边,请用所学化学知识回答下列问题。
(1)金刚石和石墨都是由碳元素组成的单质,但是由于________,因此它们的物理性质存在着较大差异;
(2)用一氧化碳和磁铁矿石(主要成分是Fe3O4)炼铁,其反应的化学方程式是_______________;
(3)用盐酸除去自行车钢圈上的铁锈,其反应的化学方程式是_______________;
(4)铝制品形成致密保护膜的化学方程式是_______________;
(5)氢化镁(MgH2)是一种贮氢合金,当它与H2O混合时释放出氢气,同时生成一种碱,该反应的化学方程式是_______________。
28、(4分)甲、乙、丙三种物质的转化关系如右图所示(“→”表示反应能一步实现,部分反应物、生成物和反应条件均已略去),请回答下列问题。

(1)若乙是最常用的溶剂,丙是单质,则甲可能是__________(填化学式);
(2)若甲是一种黑色固体,乙和丙是组成元素相同的两种气体,写出丙→乙转化的化学方程式_______________;
(3)若甲是纯碱,乙是一种常见的温室气体,则丙可能是____________(填化学式),写出乙→丙转化的化学方程式_______________。
七、计算题(本题包括1小题,共3分)
29、(3分)为测定某石灰石矿中碳酸钙的含量,现称取12.5g石灰石矿样品与足量的稀盐酸反应(杂质不溶于水,也不参与反应),得到二氧化碳气体4.4g(假设生成的气体全部逸出)。请计算:该石灰石样品含CaCO3的质量分数?
八、探究与实验题(本题包括2小题,共8分)
30、(3分)下图是实验室制取气体的发生装置和气体收集装置。
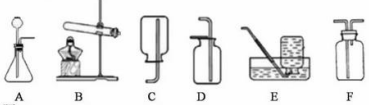
回答下列问题:
(1)用装置B和E制取氧气,其反应的化学方程式是_____________________。
(2)现需要制取并收集一瓶氢气,在装置A、B、C、D、E中,应选择的装置组合是____________________。
(3)C、D、E、F都是实验室制取气体的收集装置,其中装置C和装置E不能用来收集二氧化碳,则不能用装置E的原因是____________________。
31、(5分)对比实验是化学研究中经常采用的方法。化学兴趣小组的同学在研究CO2通入NaOH溶液是否发生了反应,设计了下列二组实验。请和化学兴趣小组的同学一起探究并回答问题:
【设计与实验】
实验 序号 | 实验步骤一 | 实验步骤二 | 实验 序号 | 实验步骤一 | 实验步骤二 |
实验I |
|
| 实验II |
|
|
【探究与结论】
(1)实验I中步骤一看不到明显现象,步骤二产生的现象是____________________。(2)实验Ⅱ中步骤二看到有白色沉淀析出,则发生反应的化学方程式是__________。
(3)在实验Ⅱ的步骤一中CO2和NaOH溶液一定发生了化学反应,但却看不到明显的现象,原因是____________________。
【拓展延伸】现有下列信息:
资料卡片一 20℃NaOH、Na2CO3在水中的溶解度 物质 溶解度(S)/g NaOH 109 Na2CO3 21.8 |
资料卡片二 20℃NaOH、Na2CO3在乙醇中的溶解度 物质 溶解度(S)/g NaOH 17.3 Na2CO3 <0.01 |
请你和化学兴趣小组的同学一起利用以上料信息再设计实验Ⅲ,证明CO2确实与NaOH发生了化学反应。
实验Ⅲ的操作为:_____________________________。
看到的现象是_________________________________。
2018黄冈中考化学真题试卷答案
说明:凡要求写化学式或化学方程式的,若化学式有误、化学方程式未配平不给分;仅未写反应条件或未标出“↑”、“↓”等符号的扣该方程式一半分。
五、选择题:(每小题只有一个选项符合题,每题2分,共16分)
18—25 BDAADBCC
六、填空简答题(本题包括3小题,共13分)
26、(每空1分,共4分)
(1)B(2)水(3)CaF2(4)SO2+I2+2H2O=H2SO4+2HI
27、(每空1分,共5分)
(1)它们碳原子的排列方式不同 (2)Fe3O4+4CO ![]() 3Fe+4CO2
3Fe+4CO2
(3)6HCl+Fe2O3= 2FeCl3+3H2O (4)4A1+3 O2= 2Al2O3
(5)MgH2+2H2O=Mg(OH)2+2H2↑
28、(每空1分,共4分)
(1)H2O2或H2SO4、HCl其它合理答案也给分
(2)CO2+C ![]() 2CO或2CO+O2
2CO或2CO+O2 ![]() 2CO2
2CO2
(3)CaCO3或BaCO3其它合理答案可给分
CO2+Ca (OH)2=CaCO3+H2O
七、计算题(本题包括1小题,共3分)
29、(共3分)
解:设该石灰石样品含CaCO3的质量分数为X
CaCO3+2HCl=CaCl2 +H2O+CO2↑ ………… 1分
100 44
12.5g·X 4.4g
100/44=12.5g·X/4.4g …………1分
X=80% …………1分
答:该石灰石样品含CaCO3的质量分数为80%
八、探究与实验题(本题包括2小题,共13分)
30、 (1) 2KC1O3 ![]() 2KC1+3O2↑或2KMnO4 K2MnO4+MnO2+O2↑
2KC1+3O2↑或2KMnO4 K2MnO4+MnO2+O2↑
(2)AC或AE 只答AC或只答AE也给满分
(3)二氧化碳能溶于水且可与水反应
31、(每空1分,共5分)
(1)有气泡冒出
(2)CaCl2 +Na2CO3 =CaCO3↓+2NaCl
(3)CO2与NaOH溶液反应生成易溶于水的Na2CO3

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...