![]() 2018年枣庄中考化学冲刺试题【精选word版 含答案】
2018年枣庄中考化学冲刺试题【精选word版 含答案】
由于格式问题,部分试题会存在乱码的现象,请考生点击全屏查看!
一、选择题(本大题包括13小题,每小题3分,共39分。在每小题列出的四个选项中,只有一个是正确的)
8.下列关于燃烧与灭火的叙述中不正确的是( )
A.将煤粉制成蜂窝煤,能增大与空气的接触面积
B.堆放杂物的纸箱着火用水浇灭,降低了可燃物的着火点
C.“釜底抽薪”蕴含的灭火原理是移除可燃物
D.可燃物在有限的空间内急剧燃烧,可能会引发爆炸
9.下列说法中不正确的是( )
A.铵态氮肥不能与碱性物质混合施用,否则肥效降低
B.浓盐酸具有挥发性,需要密封保存
C.仅通过加水溶解不能鉴别NaCl、NH4NO3、CuSO4三种白色固体
D.用食醋清除水垢,是利用了食醋的酸性
10.除去下列物质中的杂质(括号内为杂质),所选用的试剂不正确的是( )
A.Cu(CuO):氢气 B.MgCl2溶液(CuCl2):镁粉
C.Na2SO4溶液(Na2CO3):稀盐酸 D.KNO3溶液(CuSO4):Ba(OH)2溶液
11.运用右图所示装置探究可燃物的燃烧条件,下列说法正确的是( )
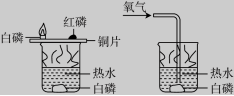
图1 图2
A.此组实验烧杯中的热水只起提高温度的作用
B.图1和图2中水下白磷对比说明燃烧必须有氧气参与
C.图1中铜片上的白磷和红磷对比说明燃烧必须有氧气参与
D.图1中铜片上的红磷和水下的白磷对比说明燃烧必须达到可燃物的着火点
12.类推是化学学习中常用的思维方法,以下类推结果中正确的是( )
A.金属铁与盐酸反应生成FeCl2和H2,则金属铜与盐酸反应生成CuCl2和H2
B.碱溶液能使无色酚酞溶液变红,则能使无色酚酞溶液变红的一定是碱溶液
C.氢气点燃前需要验纯,则可燃性气体点燃前都需要验纯
D.复分解反应中有沉淀、气体或水生成,则有上述物质生成的反应就一定是复分解反应
13.下列实验操作、现象与结论对应关系不正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 用硬铝在铝片上刻画 | 铝片上有划痕 | 硬铝的硬度比纯铝大 |
B | 用小木棍蘸少量浓硫酸 | 木棍变黑 | 浓硫酸具有脱水性 |
C | 将用水润湿一半的紫色石蕊纸花放入充满二氧化碳的广口瓶中 | 紫色石蕊纸花干燥的一半不变红,湿润的一半变红 | 二氧化碳和水发生了化学反应 |
D | 向某溶液中滴入稀盐酸 | 有气泡产生 | 溶液中一定含CO |
14.下列图像能正确反映其对应的实验操作的是( )
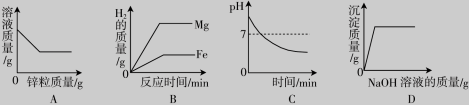
A.向一定量的CuSO4溶液中加入锌粒
B.将等质量的镁和铁分别投入到等质量、相同质量分数且足量的稀硫酸中
C.服用胃舒平[主要成分是Al(OH)3]治疗胃酸过多,胃液pH的变化
D.向FeCl3和HNO3的混合溶液中加入NaOH溶液直至过量
8.下列实验不能达到目的的是( )
|
|
|
|
A.探究同种物质在不同溶剂中的溶解性 | B.测定空气中氧气含量 | C.证明分子是不断运动的 | D.验证质量守恒定律 |
9.下列关于物质检验和区分的方法不正确的是( )
A.用水检验NaOH、NH4NO3、CaCO3三种固体
B.用燃着的木条检验O2、CH4、CO2
C.用碳酸钠区分CaCl2、Ca(OH)2、NaOH三种溶液
D.观察溶液颜色区分CuSO4溶液、Na2SO4溶液、FeSO4溶液
10.下列方法中,不能达到目的的是( )
选项 | 物质(括号内为杂质) | 除去杂质的方法 |
A | NaOH溶液(Na2SO4) | 加入适量的Ba(OH)2溶液,过滤 |
B | CaO(CaCO3) | 加水溶解,过滤 |
C | FeSO4液体(CuSO4) | 加入过量的铁粉,过滤 |
D | CuSO4溶液(H2SO4) | 加入足量的氧化铜粉末,过滤 |
11.下列各组物质,只用稀盐酸就能将三种物质区分开来的是( )
A.澄清石灰水、酚酞溶液、硝酸银溶液
B.食盐水、稀硫酸、碳酸氢钠溶液
C.木炭粉、氧化铜粉末、铁粉
D.硝酸钾溶液、氯化钡溶液、硫酸钠溶液
12.某无色气体可能由H2、CH4、CO、CO2中的几种组成。将混合气体通过过量的澄清石灰水,出现白色浑浊;将剩余气体导出,经干燥后点燃,罩在火焰上方的干燥烧杯内壁有水珠生成。该混合气体的可能组成是( )
A.H2、CH4 B.CO2、CO
C.H2、CH4、CO D.CH4、CO、CO2
13.下列实验操作、现象与结论对应关系正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向醋酸中加入氢氧化钠溶液 | 无明显现象 | 二者之间不发生反应 |
B | 向某固体中滴加稀硫酸 | 产生气泡 | 该固体中一定含有碳酸盐或碳酸氢盐 |
C | 电解水 | 电极上有气泡产生 | 水电解有气体生成 |
D | 向某烧碱溶液中滴入酚酞溶液 | 溶液变红色 | 该烧碱溶液未变质 |
二、实验与探究题(本大题包括4小题,共61分)
14.(8分) 工业上常采用“天然苛化法”制取氢氧化钠,部分流程如下:

(1)操作1的名称是__________,写出实验室中该操作必需的一种玻璃仪器的名称__________。
(2)写出流程中发生苛化反应的化学方程式:________________________。
(3)工艺中采用石灰乳而不用氢氧化钙溶液与碳酸钠反应,是因为___________________。
(4)生产工艺中可以回收再利用的物质是__________(写名称)。
(5)由天然碱得到碳酸钠溶液时,将天然碱粉碎的目的是_______________________。
15.(18分)为了除去KCl溶液中的少量MgCl2和MgSO4,从Na2SO4溶液、稀盐酸、Ba(NO3)2溶液、K2CO3溶液、Ba(OH)2溶液中选择A、B、C三种试剂,按以下步骤实验:
![]()
(1)A、B、C三种试剂中的溶质的化学式是A__________、B__________、C__________。
(2)在实验Ⅰ中,所加的A溶液应该过量,原因是__________________________________,有关的化学方程式是______________________和________________________________。
(3)实验Ⅱ中加过量B的目的是__________________________,有关的化学方程式是____________________________________。
(4)实验Ⅲ中,要得到较为纯净的KCl溶液,所加试剂C应当适量。在此实验中,当试剂加到________________________________的时候,就应停止再加。
16.(19分)根据图1所给的仪器,回答问题:

图1
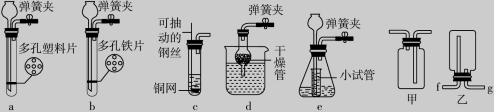
图2 图3
(1)写出图1中仪器C的名称____________。
(2)用B、D和__________(填字母,下同)可组装成一套实验室制取氧气的发生装置,使用该套装置制取气体的突出优点是____________________________________,用该装置制取氧气的化学方程式为____________________________________。
(3)装配氯酸钾制备O2的发生装置需要用到的仪器有__________。
(4)实验室制备CO2时,要求能随时控制反应进行或停止,图2的发生装置正确且符合要求的是__________;如图2所示,装置e中小试管起到节约液体药品和______________的作用。
(5)如图3所示,用大理石和浓盐酸制取CO2时,为了得到纯净、干燥的CO2,某同学在发生装置后连续接了两个甲装置,再连接乙进行收集。第一个甲装置内为足量的饱和碳酸氢钠溶液,则第一个甲装置的作用是____________________________________,第二个甲装置应该注入足量的__________;用乙装置收集二氧化碳时,气体应从________(填“f”或“g”)端进入。
17.(16分)某化学兴趣小组的同学在学习九年级《化学》下册中的资料卡片“石笋和钟乳石的形成”时,发现难溶于水的碳酸钙当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O=== Ca(HCO3)2,联想到实验室中澄清石灰水与二氧化碳反应会生成碳酸钙:Ca(OH)2+CO2=== CaCO3↓+H2O,对长时间向碱溶液中通入CO2,反应后溶液中的溶质组成产生了浓厚的兴趣。
【提出问题】一定量CO2与NaOH溶液反应后的溶质组成是什么?
【查阅资料】
(1)通入少量CO2反应的化学方程式为____________________________________。
(2)通入过量CO2,反应的化学方程式为Na2CO3+CO2+H2O=== 2NaHCO3。
(3)碳酸氢盐都是可溶于水的,BaCO3难溶于水。
(4)碳酸氢钠溶液呈碱性。
【提出猜想】
(1)溶质为NaOH和Na2CO3;
(2)溶质为Na2CO3;
(3)溶质为__________________(填化学式);
(4)溶质为NaHCO3。
【设计实验】
实验步骤 | 实验现象 | 实验结论 |
(1)用玻璃棒蘸取反应后溶液,滴在pH试纸上 | pH=9 | 该溶液显______性 |
(2)取反应后溶液少许于试管中,向其中滴加过量的BaCl2溶液 | 有__________生成 | 猜想(4)不成立 |
(3)取步骤(2)中的上层清液,滴入稀盐酸 | 有气泡冒出 | 猜想______不成立 |
【得出结论】猜想(3)成立。
【讨论交流】
(1)有同学提出,实验步骤(1)是多余的。你认为该实验设计是否需要?__________(填“需要”或“不需要”)。
(2)同学们又一次把目光投向了教材,发现遇热或压强变小时:Ca(HCO3)2=== CaCO3↓+CO2↑+H2O,纷纷提出,干粉灭火器中用NaHCO3灭火的反应原理与之相似,试写出NaHCO3受热分解的化学方程式:____________________________________。
【反思应用】向澄清石灰水中不断通入二氧化碳,观察到的现象是__________________________。
![]() 2018年枣庄中考化学冲刺试题参考答案
2018年枣庄中考化学冲刺试题参考答案
一、选择题(本大题包括13小题,每小题3分,共39分)
8.B 9.C 10.C 11.B 12.C 13.D 14.B 8.C 9.C 10.B 11.C 12.D 13.C
二、实验与探究题(本大题包括4小题,共61分)
14.(8分,每空2分) (1)过滤(1分) 漏斗(或烧杯或玻璃棒)(1分)
(2)Ca(OH)2+Na2CO3 CaCO3↓+2NaOH(2分)
(3)氢氧化钙微溶于水,溶液中的氢氧化钙含量太低,影响生成物的量(1分) (4)碳酸钙(1分) (5)加快溶解速率(2分)
15.(18分,每空2分)(1)Ba(OH)2 K2CO3 HCl
(2)为了除尽Mg2+和SO
MgCl2+Ba(OH)2=== Mg(OH)2↓+BaCl2
MgSO4+Ba(OH)2=== Mg(OH)2↓+BaSO4↓
(3)除去过量的Ba2+
Ba(OH)2+K2CO3=== BaCO3↓+2KOH
(4)刚好无气泡放出
16.(19分,除标注外,每空2分)(1)长颈漏斗(1分)
(2)GH 可以控制反应的速率 2H2O2 2H2O+O2↑
(3)ABFH (4)acd 液封
(5)除去杂质氯化氢气体 浓硫酸 g
17.(16分,每空2分)【查阅资料】CO2+2NaOH=== Na2CO3+H2O
【提出猜想】NaHCO3和Na2CO3
【设计实验】(1)碱 (2)白色沉淀 (3)(1)和(2)
【讨论交流】(1)不需要
(2)2NaHCO3 Na2CO3+CO2↑+H2O
【反思应用】石灰水先变浑浊,后又变澄清

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...