原子半径大小判断:如果电子层数不一样,电子层数大的离子半径大;如果电子层数相同,质子数小的半径大;根据化学元素周期表。在同一个族里,从上到下,原子半径一般是增大的,因为从上到下电子层数增多,所以,原子半径增大。主族元素与副族元素的变化情况很不一样。

1、如果电子层数不一样,电子层数大的离子半径大;
2、如果电子层数相同,质子数小的半径大;
3、根据化学元素周期表;
在同一个族里,从上到下,原子半径一般是增大的,因为从上到下电子层数增多,所以,原子半径增大。主族元素与副族元素的变化情况很不一样。主族元素由上到下,半径毫无例外地增大,只是增大的幅度逐渐减小。
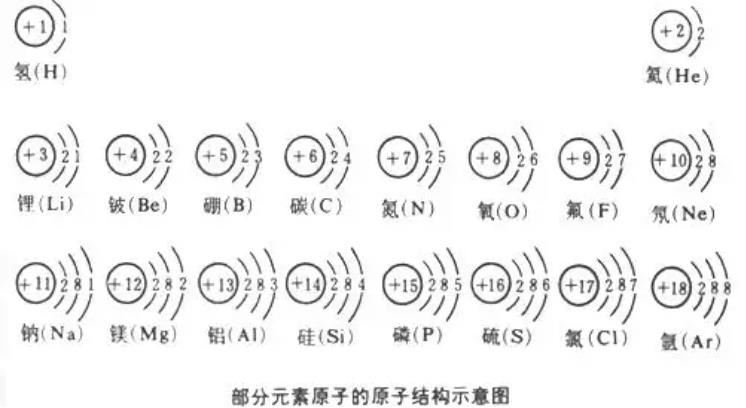
一是核电荷数,核电荷数越多原子核对核外电子的引力越大(使电子向原核收缩),则原子半径越小;当电子层数相同时,其原子半径随核电荷数的增加而减小;
二是最外层电子数,最外层电子数越多半径越大;
三是电子层数(电子的分层排布与离核远近空间大小以及电子云之间的相互排斥有关),电子层越多原子半径越大。当电子层结构相同时,质子数越大,半径越小。

原子变离子是吸热。只要是是去电子就是吸热,因为电子要逃离原子核对他的束缚。金属,原子失去电子变成离子,需要吸收能量;非金属,原子得到电子变成...

1、元素是具有相同核电荷数的同一类原子的总称;原子是化学变化中的最小粒子。2、元素着眼于种类不表示个数,没有数量多少的含义;原子既表示种类又...

分子是由组成的原子按照一定的键合顺序和空间排列而结合在一起的整体,这种键合顺序和空间排列关系称为分子结构;原子指化学反应不可再分的基本微粒,...

对多原子分子来说,分子比原子大。通俗点说,不同物质的分子和原子不能直接比较,因为不管是体积还是质量有的分子大于原子,有的原子大于分子。由于分...

分子、原子和离子是构成物质的一种粒子,原子右下方没有数字,分子右下方有数字,离子右上方有数字和+或-。分子是由组成的原子按照一定的键合顺序和...

一个分子或原子可以是一个系统,但不是生命系统。系统是指有一定结构,并且这些结构之间有一定的相互联系,因此一个分子或一个原子也是一个系统。而生...

如果这个电子在围绕原子核的半径最小轨道内,则原子的能量最低,称此为原子的基态。如电子在更大的半径上,则原子能量更高,处于激发态。而将一个电子...

分子与原子的区别:在化学变化中是否可以再分。分子是保持物质化学性质的最小粒子,原子是化学变化中的最小粒子。在化学变化中分子可分,原子不能再分...