请点击全屏查看
2017年攀枝花市高中阶段教育学校招生统一考试
化学试题2017.06
本试题卷分第一部分(选择题)和第二部分(非选择题)两部分,共6页,满分100分。考生作答时,须将答案答在答题卡上,在本试题卷、草稿纸上答题无效。考试结束后,将本试题卷和答题卡一并交回。
可能用到的相对原子质量:
H - 1 C - 12 N – 14 O - 16 Al-27 P-31 S-32 Cl - 35.5
K-39 Ca – 40 Mn-55 Fe-56 Cu-64
第Ⅰ卷 (选择题,共40分)
一、选择题(每小题2.5分,共40分,每小题只有一个选项符合题意)
1.下列我国著名科学家中,为相对原子质量的测定作出了卓越贡献的是
A. 钱学森 B. 屠呦呦 C.张青莲 D. 侯德榜
2.银针是中医针灸的常用器械。银的元素符号是
A.Au B.Ag C.Mg D.Hg
3.(2017攀枝花化学)开发和利用新能源是国家能源战略发展的方向。下列不属于新能源的是
A.天然气 B.核能 C.太阳能 D.风能
4.下列物质中,由分子构成的是
A.镁 B.金刚石 C.氯化钠 D.水
5.研究结果显示:用2%的小苏打溶液漱口能有效预防口腔粘膜溃疡的发生。小苏打属于
A.盐 B.酸 C.碱 D.氧化物
6.洋葱中含有一种具有强烈刺激性气味的物质-正丙硫醇。切洋葱时人会流眼泪,从分子的角度解释正确的是
A.分子大小发生改变 B.分子之间有间隔
C.分子在不断运动 D.分子可以再分
7.小林从冰箱里拿出冰冻的饮料,用干布擦净瓶外壁的水,放置于桌面片刻,发现瓶外壁又挂满水珠。这说明空气中有
A.氮气 B.水蒸气 C.二氧化碳 D.氧气
8.攀枝花市某地的土壤呈弱碱性。下列农作物中,适宜在该地种植的是
选项 | A | B | C | D |
农作物 | 茶树 | 油菜 | 棉花 | 甘 草 |
适宜作物生长的pH | 5.0~5.5 | 5.8~6.7 | 6.0~6. 8 | 7.2~8.5 |
9.(2017攀枝花化学)下列各图所示实验操作中,正确的是
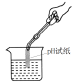
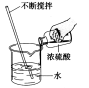
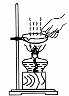
A.测溶液的pH B.读出液体体积 C.稀释浓硫酸 D.移走蒸发皿
10.下列现象中,没有发生化学变化的是
A.浓硫酸溅到白纸上,白纸变黑
B.建筑工地上生石灰长时间露天放置
C.盛放澄清石灰水的试剂瓶口出现一层白色固体
D.敞口放置的氯化钠饱和溶液中有白色固体析出
![]() 11(2017攀枝花化学).雷阵雨过后,空气特别清新,原因之一是空气中少量氧气(O2 )转化为臭氧(O3),表示为:
11(2017攀枝花化学).雷阵雨过后,空气特别清新,原因之一是空气中少量氧气(O2 )转化为臭氧(O3),表示为:
3O2 2O3 。下列说法中正确的是
A.等质量的 O2与O3所含原子数相等 B.O2 转化为O3属于物理变化
C.O2与O3的相对分子质量相等 D.O2 与O3都是化合物
12.质量相同的下列四种物质,完全分解后制得氧气质量最多的是
A.H2O2 B.H2O C.KClO3 D.KMnO4
13.在氯化钡溶液中滴入某种液体,生成白色沉淀。有关说法错误的是
A.滴入的可能是硝酸银溶液 B.反应后溶液可能呈酸性
C.白色沉淀可能溶于盐酸 D.该反应可能是中和反应
14.(2017攀枝花化学)活性炭可处理大气污染物NO。在一定条件下的密闭容器中,NO气体与活性炭中的C反应生成甲、乙两种气体,其中甲是空气中含量最多的气体。测得各物质的质量如下表所示:
物质质量 /g 反应时间/min | 活性炭 | NO | 甲 | 乙 |
0 | 28.72 | 5.00 | 0 | 0 |
4 | 28.00 | 1.40 | x | 2.64 |
下列说法正确的是
A.生成甲、乙的分子数之比为1:1
B.反应消耗的C与NO的质量之比为2:5
C. x的值为26.76
D.反应中活性炭只起吸附作用
15.某研究所利用热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,获得相关数据,绘制成固体质量—分解温度的关系如图所示。下列说法正确的是
 A.CaC2O4·xH2O中x=2
A.CaC2O4·xH2O中x=2
B.500~650℃范围内的残留固体为CaC2O4
C.固体质量由12.8g变为10.0g时发生的反应为
CaC2O4 ![]() CaCO3 + CO↑
CaCO3 + CO↑
D.8000C以上时,固体成分的化学式为CaCO3
16.(2017攀枝花化学)用铁粉和氧化铜的混合物8.32g进行如下实验:
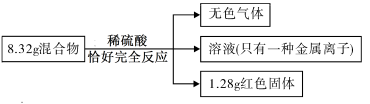
下列说法正确的是
A.8.32g混合物中含铁粉7.04g
B.无色气体质量为0.20g
C.溶液中硫酸亚铁的质量为15.20g
D.实验中参与反应的H2SO4的质量为9.80g
第Ⅱ卷 (非选择题 共60分)
二、填空题(本大题包括17、18、19、20题,共19分)
17.(4分)用化学用语填空:
(1)4个钾离子 。 (2)4个二氧化硫分子 。
(3)干冰的化学式 。(4)由4个磷原子构成的单质分子 。
18.(2017攀枝花化学)(6分)我国自主研发的“硅衬底高光效氮化镓(GaN)发光二极管(简称LED)技术”已广泛应用于照明、显像等多个领域。请回答下列问题:
(1)有以下微粒的结构示意图: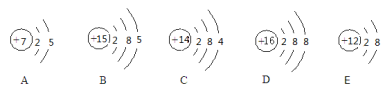
上述微粒中,属于硅原子的是 (填序号),属于阳离子的是 (填序号),化学性质相似的是 (填序号),D粒子的化学符号为 。
(2)镓(Ga)的原子结构示意图为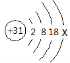 ,x= 。磷化镓也是制造LED的一种材料,其化学式为 。
,x= 。磷化镓也是制造LED的一种材料,其化学式为 。
19.(5分)铬(Cr)及其化合物如:三氧化二铬(Cr2O3)、铬酸钠 (Na2CrO4)、重铬酸钠(Na2Cr2O7)等是工业中有重要作用的物质。有如下反应:
① Cr2O3 + 3Ca ![]() 2Cr + 3CaO
2Cr + 3CaO
② 2Cr2O3 + 3O2 + 8NaOH ![]() 4Na2CrO4 + 4H2O
4Na2CrO4 + 4H2O
③ 2Na2CrO4 + H2SO4 ![]() Na2Cr2O7 + X + H2O
Na2Cr2O7 + X + H2O
回答下列问题:
(1)反应③中X的化学式为 。在上述反应中,属于置换反应的是 ,反应后铬元素化合价升高的是 。
(2)Ca-CaCrO4电池是战术导弹的常用电源。向Na2CrO4溶液中加入CaCl2溶液可得CaCrO4沉淀,反应的化学方程式是 。
20.(2017攀枝花化学)(4分)甲、乙、丙三种固体物质的溶解度曲线如图所示。回答下列问题:
 (1)t1℃时,将25g丙固体加入到50g水中,充分溶解并恢复到原温度后,得到溶液的质量为 g。
(1)t1℃时,将25g丙固体加入到50g水中,充分溶解并恢复到原温度后,得到溶液的质量为 g。
(2)现有操作步骤:a.溶解 b.过滤 c.降温结晶 d.加热浓缩。若甲固体中含有少量乙,则提纯甲的操作步骤是 (填序号)。
(3)将t2℃时甲、乙、丙三种固体物质的饱和溶液降温到t1℃,其溶质质量分数由大到小的顺序是 。
(4)向100g t2℃的水中加入55g甲的固体,发现全部溶解,一段时间后又有部分甲的固体析出。“全部溶解”的原因可能是 。
三、简答题(本大题包括21、22、23题,共17分)
21.(5分)生活中处处有化学知识。回答下列问题:
(1)人们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有 作用。
(2)常用 检验水样是否属于硬水。 若为硬水,常采取 的方法降低硬度。
(3)炒菜时锅中的油起火燃烧,若向燃着的油锅里加水,不但不能灭火,还会使油滴飞溅出来燃烧更加剧烈,其原因是 。正确的方法是用锅盖盖灭,其原理是 。
22.(5分)小明将未经砂纸打磨的铝条放入盛有足量稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图所示。
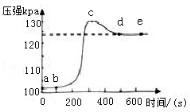 回答下列问题:
回答下列问题:
(1)ab段发生反应的化学方程式是 。
(2)bc段发生反应的化学方程式是 。
(3)cd段压强变化的主要原因是 。
23.(2017攀枝花化学)(7分)工业上常利用石灰浆[主要成分为Ca(OH)2]制备化工原料KClO3的流程如下:

已知:①反应1为:6Cl2 + 6Ca(OH)2![]() Ca(ClO3)2 + 5CaCl2 + 6H2O。
Ca(ClO3)2 + 5CaCl2 + 6H2O。
②有关物质在常温下的溶解度如下:
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
溶解度/g | 209.0 | 74.5 | 7.3 | 34.0 |
回答下列问题:
(1)在实验中两次涉及过滤操作,完成此操作需要的玻璃仪器有烧杯、玻璃棒、 ,该操作中玻璃棒的作用是 。
(2)Ca(ClO3)2的名称是 。对于反应1,参加反应的Cl2中有一部分Cl的化合价升高,另一部分降低,则化合价升高的Cl与化合价降低的Cl 的个数比为 。
(3)反应2为KCl与Ca(ClO3)2发生的复分解反应,该反应能发生的主要原因是 。溶液A中含有的溶质为CaCl2和 (填化学式)。
(4)上述流程中析出的KClO3晶体表面通常吸附有Ca2+、Cl-等杂质离子,过滤时洗涤KClO3晶体,应选用下列中的 饱和溶液(填编号)。
A.KCl B.CaCl2 C.KClO3 D.Na2CO3
四、实验题(本大题包括24、25题,共12分)
24.(2017攀枝花化学)(5分)某学习小组在实验室中看到氢氧化钠(固体)试剂瓶标签上标注着“NaOH含量不少于96.0%”,提出对氢氧化钠固体中主要含有的杂质成分进行探究。
【提出问题】氢氧化钠固体中主要含有什么杂质?
【查阅资料】工业制取NaOH的反应原理是:2NaCl + 2H2O![]() 2NaOH + H2↑ + Cl2↑,然后蒸发溶剂获得氢氧化钠固体。
2NaOH + H2↑ + Cl2↑,然后蒸发溶剂获得氢氧化钠固体。
【提出猜想】氢氧化钠固体中主要杂质为Na2CO3和NaCl。
小组同学猜想含有NaCl的理由是:原料中的氯化钠没有完全转化为氢氧化钠;含有Na2CO3的理由是: 。
【实验探究】
实验步骤 | 实验现象 | 实验结论 |
步骤①:取少量固体样品溶于水。 | 固体溶解,溶液温度明显上升 |
猜想正确 |
步骤②:待步骤①中溶液冷却后,向溶液中滴加过量 。 | 开始无明显变化,后产生气泡 | |
步骤③:向步骤②所得溶液中滴加 溶液。 | 产生白色沉淀 |
【实验反思】步骤②所得溶液中的溶质除NaCl外,还有 。
25.(7分)氯化亚铁具有独特的脱色能力,广泛用于印染、造纸等行业。某课题小组设计如下方案制备氯化亚铁。
已知:①氯化铁易与水反应;②在加热条件下,氢气能与氯化铁反应生成FeCl2和HCl。
③碱石灰中含有CaO与NaOH
小组同学设计下列装置制备少量氯化亚铁(装置不能重复使用)。
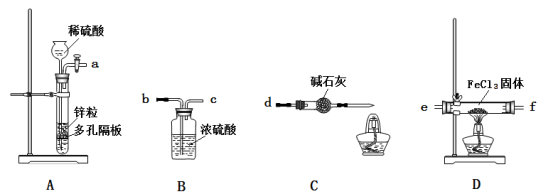
回答下列问题:
(1)实验开始前应先检验装置的气密性。请叙述检验装置A气密性的方法:关闭活塞, 。
(2)气流从左至右,装置接口连接顺序是: a→ ( )→( )→( )→( )→d
(3)装置D中发生反应的化学方程式是 。
(4)装置C中碱石灰的作用是防止空气中的水蒸气进入和 。
(5)实验过程中,在点燃装置D中的酒精灯之前,从安全角度考虑必须要进行的操作是 。
五、计算题(本大题包括26、27题,共12分)
26.(2017攀枝花化学)(4分)施肥是农业增产的重要手段,CO(NH2)2、(NH4)2HPO4是常用的化学肥料。
回答下列问题:
(1)(NH4)2HPO4中N和H原子的个数比为 。
(2)CO(NH2)2的相对分子质量 。
(3)经农科所技术人员检测,某农户的农作物缺磷和氮。若需补充磷3.1kg和氮7.0kg,则至少需要施用 kg(NH4)2HPO4和 kg CO(NH2)2。
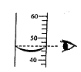
27.(8分)工业合成盐酸中通常溶有少量的FeCl3。工业合成盐酸的国家质量标准规定:含HCl的质量分数<31.0%或含铁(以Fe计) 的质量分数>0.01%的产品均为不合格产品。
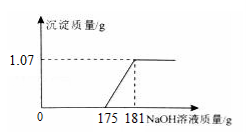 某厂质检室对本厂生产的某一批次工业合成盐酸进行质量检验,方法是:取该批次产品l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如右图所示。
某厂质检室对本厂生产的某一批次工业合成盐酸进行质量检验,方法是:取该批次产品l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如右图所示。
请你计算产品中含HCl的质量分数和含铁(以Fe计) 的质量分数,并判断该批次产品是否合格。(写出计算过程,计算结果精确到0.1%)
2017攀枝花化学参考答案
选择题(每小题2.5分,共40分)
1. C 2. B 3. A 4. D 5. A 6. C 7. B 8. D
9. C 10. D 11. A 12. B 13. D 14. A 15. C 16. B
二、填空题(本大题包括17、18、19、20题,共19分)
17(共4分)
(1)4K+ (1分) (2)4SO2 (1分) (3)CO2 (1分) (4)P4 (1分)
18(共6分)
(1)C (1分) E (1分) AB (1分) Cl- (1分) (2)3 (1分) GaP (1分)
19(共5分)
(1)Na2SO4 (1分) ① (1分) ② (1分)
(2)Na2CrO4 + CaCl2 ![]() CaCrO4↓+ 2 NaCl (2分)
CaCrO4↓+ 2 NaCl (2分)
20(共4分)
(1)61 (1分) (2)adcb (1分)
(3)乙>甲>丙 (4)甲固体溶于水时放热 (1分)
三、简答题(本大题包括21、22、23题,共17分)
21.(共5分)
(1) 乳化 (1分) (2) 肥皂水 (1分) 煮沸 (1分)
(3)水的密度比油大下沉,水的沸点比油低导致暴沸 (1分) 隔绝空气 (1分)
22. (共5分)
(1)Al2O3 + 6HCl ═ 2AlCl3 + 3H2O (2分) (2)2Al + 6HCl ═ 2AlCl3 + 3H2↑ (2分)
(3)气体温度降低 (1分)
23(共7分)
(1)漏斗 (1分) 引流(1分) (2)氯酸钙 (1分) 1:5 (1分)
(3)氯酸钾的溶解度最小(1分) KClO3 (1分) (4)C (1分)
四、(2017攀枝花化学)实验题(本大题包括24、25题,共12分)
24(共5分)
【提出猜想】氢氧化钠吸收空气中的CO2 (1分)
【实验探究】 稀HNO3 (1分) AgNO3 (1分)
【实验反思】NaNO3、HNO3 (2分)
25(共7分)
(1)向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好。(2分)
(2)b → c → e → f (1分) (3)H2+2FeCl3 ![]() 2FeCl2+2HCl (2分)
2FeCl2+2HCl (2分)
(4)吸收反应生成的HCl气体(1分) (5)检验氢气的纯度。(1分)
五、计算题(本大题包括26、27题,共12分)
26(共4分)
(1)2:9 (1分) (2)60(1分) (3)13.2(1分) 9(1分)
27(共8分)
解:(1)由图可知,生成Fe(OH)3沉淀的质量为1.07g,含铁:![]()
所以盐酸中含铁的质量分数为:![]() (2分)
(2分)
(2)设与FeCl3反应的氢氧化钠质量为x,与175gNaOH溶液反应的HCl质量为y
FeCl3 + 3NaOH ![]() Fe(OH)3↓ + 3NaCl
Fe(OH)3↓ + 3NaCl
3×40 107
x 1.07g
(3×40) :107= x :1.07g ∴ x=1.2g
与FeCl3反应的NaOH溶液的质量为:181g﹣175g=6g 。
![]() NaOH溶液的溶质质量分数为: (2分)
NaOH溶液的溶质质量分数为: (2分)
与盐酸反应的NaOH质量为:175g×20%=35g (1分)
HCl + NaOH ![]() NaCl + H2O
NaCl + H2O
36.5 40
y 35g
36.5 : 40 = y : 35 ∴ y =31.9g
![]() 该工业合成盐酸中HCl的质量分数是: (2分)
该工业合成盐酸中HCl的质量分数是: (2分)
∴根据国家质量标准,产品中含HCl的质量分数为31.9%,含铁(以Fe计) 的质量分数为0.56%>0.01%,该批次产品为不合格产品。 (1分)

孔乙己是贫困潦倒的知识分子。在书中,孔乙己是一个知识分子,满口“之乎者也”,但是他很穷,还窃书,说过“读书人的事,怎么能叫窃,”被人嘲笑,他...

自然界产生氧气的化学方程式:光合作用的反应式为6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反应和暗反应两个过程。需要具备光...

有的高校没有条件,只要学业水平成绩都合格就可以,比如中国科学院大学。有的需要平常学习考试成绩,比如北京外国语大学要求高三第一学期期末成绩在全...

在四则运算中,表示计算顺序,在小括号之后、大括号之前;表示两个整数的最小公倍数;表示取未知数的整数部分;在函数中,表示函数的闭区间;在线性代...

济南开设的最好的职高学校有:济南方信集团职业高中、济南公共交通职业高中。济南市公共交通职业高级中学是由济南市公共交通总公司承办,业务属济南市...

实然:是说事物实际上就是这样的,但不同于现实性(现实性指其有合理性和客观性);应然:就是应该是怎么样的意思,比如说这件事,就应该是那样的结果...

地中海气候一种夏季炎热干燥、冬季温和多雨,雨热不同期的气候类型。地中海气候冬季受西风带控制,锋面气旋频繁活动,气候温和,最冷月的气温在4-1...

碱石灰,又称钠石灰,碱石灰是白色或米黄色粉末,疏松多孔,是氧化钙(CaO,大约75%),水(H₂O,大约20%),氢氧化钠(NaOH,大约3...